- 首页
- 产品
-
重组蛋白

免疫检查点蛋白
细胞因子靶点
全长多次跨膜蛋白
-
抗体

免疫组化 (IHC) 抗体
同型对照
-
细胞培养
-
试剂盒 & 分析试剂

ELISA
qPCR试剂盒
流式细胞术
ADC 偶联试剂盒
免疫组化(IHC)试剂盒
MPCLIA
-
病毒抗原&抗体&试剂盒

新冠病毒
水痘-带状疱疹病毒
-
类器官解决方案
-
其他产品

实验仪器设备
-
细胞治疗细胞治疗
-
早期研发

通用型蛋白
药物筛选与分析服务
-
CMC - 生产

细胞培养产品
Premium(Pre-GMP) & GMP 级别原材料
基因编辑产品
-
CMC - 质量控制

残留检测试剂盒 - resDetect
-
临床前

审计&申报文件支持
-
临床
-
-
基因治疗基因治疗
-
早期研发
-
CMC - 生产

Premium(Pre-GMP) & GMP 级别原材料
基因编辑
-
CMC - 质量控制

残留检测 - resDetect
-
临床前
-
临床
-
-
抗体药抗体药
-
早期研发

-
CMC - 生产
-
CMC - 质量控制

残留检测 - resDetect
-
临床前

免疫原性研究
审计&申报文件支持
-
临床
-
-
抗体偶联药物抗体偶联药物
-
早期研发

ADC研发工具
-
CMC - 生产
-
CMC - 质量控制
-
临床前

免疫原性研究
审计&申报文件支持
-
临床
-
-
疫苗疫苗
-
早期研发
-
CMC - 生产

基因编辑
mRNA合成
-
CMC - 质量控制

抗原含量检测
疫苗生物效价检测
残留检测试剂盒 - resDetect
-
临床前

疫苗生物效价检测
-
临床

疫苗生物效价检测
-
-
所有品牌
-
Aneuro

-
ComboX
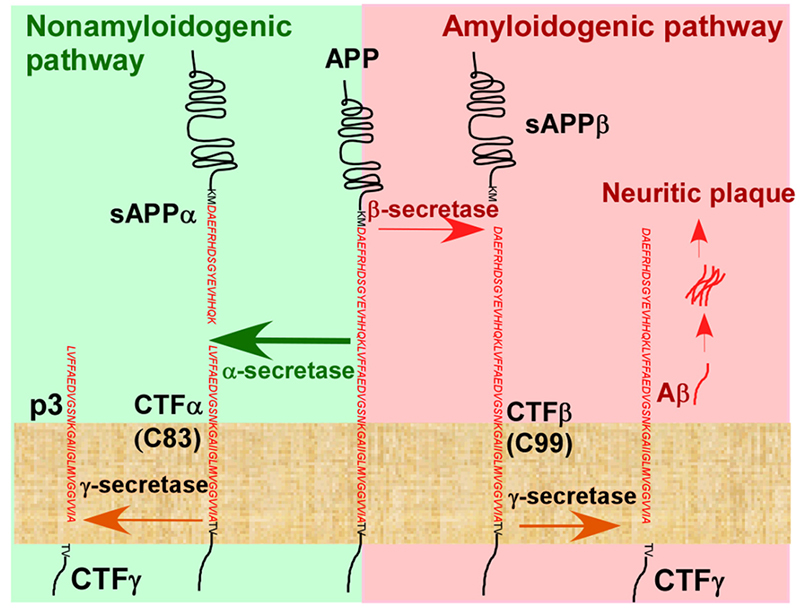
 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏! -
ViruStop
产品疗法品牌 -
- 技术服务
-
-
-
-
其他服务
-
质量&平台
-
质量管理体系
-
质检技术平台
-
特色技术平台
-
- 技术资源
- 会议&合作
-
会议
-
抗体交易平台
-
项目合作
-
- 市场活动
- 公司































 膜杰作
膜杰作 Star Staining
Star Staining